|
კარდიო-
და
ჰეპატოტროპული
ვირუსებით
გამოწვეული
გულის
უკმარისობის
მ.
როგავა
ზ.
ღურწკაია
თ.
ბოჭორიშვილი |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
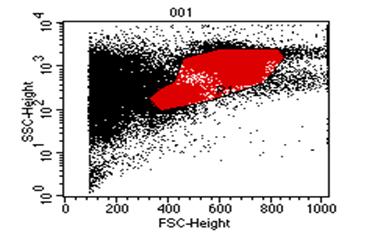
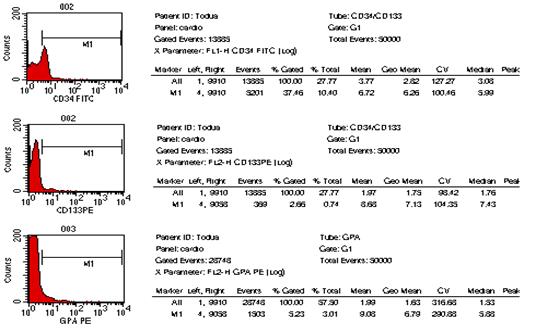
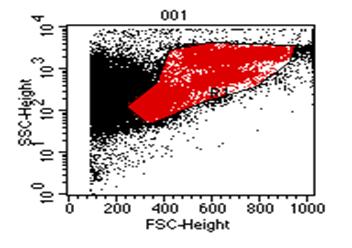
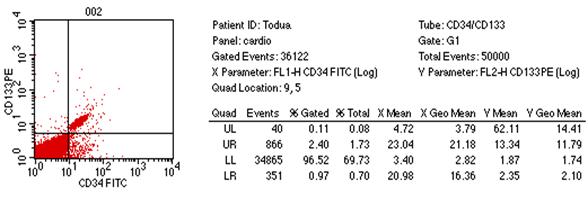
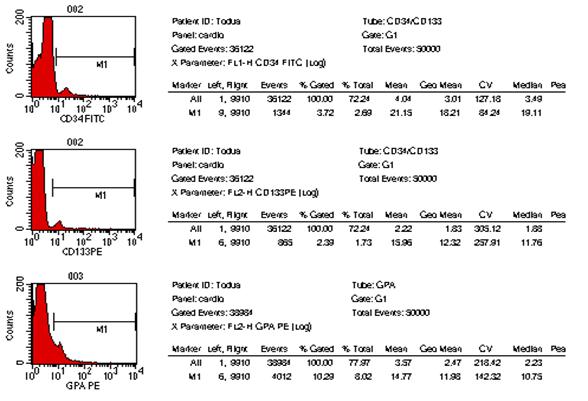
გულ-სისხლძარღვთა დაავადებები მსოფლიოს ყველა ქვეყნის ჯანდაცვის ერთ-ერთი უმნიშვნელოვანესი პრობლემაა. კვლავ მაღალია მის მიერ გამოწვეული ავადობისა და ინვალიდობის სიხშირე, სწორედ ის რჩება გულის უკმარისობისა და სიკვდილობის წამყვან მიზეზად (Martin D. et al. 2004). პრობლემა განსაკუთრებით მნიშვნელოვანია ყოფილი საბჭოთა კავშირის ქვეყნებისათვის მათ შორის საქართველოსთვის, რაც ძირითადად განპირობებულია ჯანდაცვის არსებული სისტემის დაშლითა და მკურნალობისა და დიაგნოსტიკაში ახალი თანამედროვე ტექნოლოგიებზე ჩამორჩენით (ფ. თოდუა და თანაავტ. 2004) 42. 2000 წელს რუსეთში გულ-სისხლძაარღვთა დაავადებებით ქალთა სიკვდილობამ საერთო ლეტალობის 46 % შეადგინა, ხოლო მამაკაცთა სიკვდილობამ 65 %. 43 გულის უკმარისობის, განსაკუთრებით კი რეფრაქტერული უკმარისობით შეპყრობილ პაციენტთა რიცხვი მსოფლიოს ყველა ქვეყანაში განუხრელად იზრდება. აშშ-ში გულის უკმარისობით დაავადებულთა რიცხვი მოსახლეობის 1% ს შეაადეგენს, ხოლო საშუალო ასაკის პირთათვის 10%-ს აღემატება. მსოფლიოს სხვადასხვა ავტორთა მონაცემებით კი 15%-ს აღწევს, რაც გულის უკმარისობის სინდრომის მკურნალობის სტრატეგიისა და ტაქტიკის მცდარი მიმართულებით და დღემდე არსებული საკურნალო-პროფილაქტიკური საშუალებათა არაეფექტურობით შეიძლება აიხსნას (მ. როგავა და თანაავტ. 2004). გულის უკმარისობის სამკურნალოდ პრეპარატების ფართო სპექტრსა და არამედიკამენტოზური მკურნალობის სხვადასხვა მეთოდებს იყენებენ (მათ შორის გულის უკმარისობის მკურნალობის ქირურგიულ მეთოდებს) 12. მიუხედავად ამისა პოპულაციაში მისი განვითარების სიხშირე და გავრცელება კვლავ იზრდება. ყოველივე ზემოთქმულიდან გამომდინარე დღის წესრიგში დადგა გულის უკმარისობის სამკურნალოდ პრინციპულად ახალი მიდგომების ძიების პრობლემა. აქტუალური გახდა რეგენერაციული მედიცინის განვითარების საკითხი, რომლის პირველმა გარკვეულმა მიღწევებმა ასახვა ჰპოვა 60-იანი წლების მეცნიერთა შრომებში. 3, 4, 5, 6, 7 უკანასკნელ წლებში გულის კუნთის რეგენერაციის მისაღწევად ახალი მიმართულებები და მიდგომები გამოიკვეთა. ბიოტექნოლოგიების, მოლეკულური და უჯრედული ბიოლოგიის განვითარებამ, უჯრედი არა მარტო ზემოქმედების მთავარ ობიექტად არამედ მრავალი დაავადების სამკურნალო საშუალებად აქცია 7, 9, 10. მიაჩნიათ, რომ მიოკარდიუმის ფუნქციის აღდგენა შესაძლებელია მიღწეულ იქნას კუმშვადი ელემენტების რაოდენობის გაზრდის გზით, მათში უჯრედშიდა რეგენერაციის პროცესების სტიმულირების შედეგად. ამ მიზნის მისაღწევად იყენებენ მიოკარდიუმში კარდიომიოციტების, გლუვკუნთოვანი უჯრედების, გენ-მოდიფიცირებული უჯრედების (ფიბრობლასტები, ჩონჩხის მიობლასტები), ძვლის ტვინის ღეროვანი უჯრედების, ემბრიონალური ღეროვანი უჯრედების და სხვათა იმპლანტაციას 3, 16. ყველა ახალი უჯრედული ტექნოლოგია კარდიოლოგიაში გაერთიანებულია ერთი საერთო ტერმინით-”უჯრედული კარდიომიოპლასტიკა”. უჯრედულ ტრანსპლანტაციას მთლიანი ორგანოს გადანერგვასთან შედარებით გააჩნია მთელი რიგი უპირატესობები 8. ჩანაცვლებითი უჯრედული თერაპია საშუალებას გვაძლევს კულტურალური მეთოდებით თავიდან ავიცილოთ ზეანტიგენური დონორის უჯრედებისაგან შემდგარი ორგანოს გადანერგვის აუცილებლობა, რომელიც ადრე თუ გვიან იმუნური მოცილების პროცესში ერთვება. უჯრედების გადანერგვა დოზით რეგულირებადია და შესაძლებელია მისი რამოდენიმეჯერ განმეორება. ემბრიონალური და ფეტალური უჯრედები უფრო კარგად იტანენ სითბურ იშემიას და ცივ კონსერვაციას. უჯრედული თერაპიის ღირებულება გაცილებით დაბალია მთელი ორგანოს გადანერგვასთან შედარებით. ადამიანისა და სხვა ძუძუმწოვრების ძვლის ტვინში გამოყოფენ ჰემოპოეზურ ღეროვან უჯრედებს, რომლებსაც გააჩნიათ პროლიფერაციისა და სისხლის ელემენტებად დიფერენცირების თვისება და მეზენქიმურ ღეროვან უჯრედებს, რომელთაც შესწევთ ნებისმიერი ტიპის მეზენქიმურ ქსოვილად დიფერენცირების უნარი (ტვინი, ცხიმოვანი ქსოვილი და სხვ.). მეზენქიმური ღეროვანი უჯრედები რეგენერაციის პროცესში უმთავრეს როლს თამაშობს და ძირითად “საშენ მასალას” წარმოადგენს. ბოლო წლების კვლევებმა აჩვენა, რომ ასეთი უჯრედები ყველა ორგანოში არსებობს. მიაჩნიათ რომ ორგანოს ქსოვილის დაზიანების შემთხვევაში ღეროვანი უჯრედები მიგრირებენ დაზიანების კერაში და ადგილობრივი სასიგნალო სისტემების ზემოქმედებით გარკვეული ტიპის უჯრედებად დიფერენცირდებიან. მიოკარდიუმის დაზიანების შემთხვევაში ხდება ღეროვანი უჯრედების მიგრაცია ნეკროზის უბანში, მაგრამ ეს უჯრედები გულის კუნთში არასაკმარისი რაოდენობითაა. ძვლის ტვინში არსებული მეზენქიმალური უჯრედების აღმოჩენამ ავტორები მიიყვანა მოსაზრებამდე, რომ დაზიანების შემთხვევაში ხდება ძვლის ტვინში მათი მობილიზაცია და სისხლში გადასროლა. ასეთი გზით ისინი აღწევენ ნეკროზის უბანს და მონაწილეობას იღებენ რეგენერაციის პროცესში (Orlik at al 2001). Wang et al (2000) 11 წამოაყენეს ჰიპოთეზა, რომ მიოკარდში იქმნება მიკროგარემო რომელიც ქმნის გარკვეულ პირობებს და სიგნალებს ღეროვანი უჯრედების კარდიომიოგენური დიფერენცირებისათვის. შესაძლოა ტრანსპლანტაციის ალტერნატიულ მეთოდად ძვლის ტვინში ღეროვანი უჯრედების წარმოქმნის სტიმულაცია და მისი სისტემურ სისხლის მიმოქცევაში გადასროლა მოგვევლინოს. ამ პრეპარატების ჯგუფიდან აღსანიშნავია კოლონიემასტიმულირებელი ფაქტორები: გრანულოციტური კოლონიემასტიმულირებელი ფაქტორი და გრანულოციტურ-მაკროფაგალური კოლონიემასტიმულირებელი ფაქტორი 14. Orlik D et al 2001 მიერ ნაჩვენები იქნა, რომ ვირთაგვებში ექსპერიმენტული მიოკარდიუმის ინფარქტის შემდეგ გრანულოციტური კოლონიე-მასტიმულირებელი ფაქტორის კანქვეშა შეყვანა იწვევს ინფარქტის ზონაში ახალი კარდიომიოციტების გაჩენას, ჰემოდინამიკური მაჩვენებლების გაუმჯობესებას და ცხოველების სიცოცხლის ხანგძლივობის გაზრდას. ზოგიერთი ავტორის მიერ გამახვილებულია ყურადღება გულის უკმარისობის განვითარებაში მანკიერი წრის როლის შესახებ (მ. როგავა და თანაავტ. 2002) 1. ამ კუთხით ღეროვანი უჯრედების მობილიზაცია და სისხლში მათი რაოდენობის მნიშვნელოვანი გაზრდა ახალ ინტერესს იძენს, რადგანაც მეზენქიმალურ ღეროვან უჯრედებს თეორიულად შესწევთ უნარი ჩაენაცვლონ არა მარტო გულის, არამედ მანკიერ წრეში მონაწილე სხვა ორგანოების დაზიანებულ ქსოვილსაც. ჩვენი კვლევის მიზანს წარმოადგენდა გულის უკმარისობით დაავადებულ პაციენტთა პერიფერიული სისხლის ბირთვიან უჯრედებში ღეროვანი უჯრედების, პროგენიტორებისა და ერითროიდული ხაზის ახალგაზრდა ფორმების პროცენტული რაოდენობის განსაზღვრა და მისი კავშირის დადგენა გულის უკმარისობის სიმძიმეს შორის. პერიფერიული სისხლის ბირთვიან უჯრედებზე, გამდინარე ციტომეტრიის მეთოდით ხდებოდა CD34, CD133 და CD235 (GP-A) ზედაპირული ანტიგენების ექსპრესიის შესწავლა მონოკლონარული ანტისხეულების გამოყენებით. CD34-წარმოადგენს ტრანსმემბრანულ გლიკოპროტეინს, რომელიც ექსპრესირდება ჰემოპოეზურ ღეროვან უჯრედებსა და პროგენიტორებზე. უკანასკნელი ათწლეულის განმავლობაში ის გამოიყენებოდა ჰემოპოეზური ღეროვანი უჯრედებისა და პროგენიტორების აღმომჩენ მარკერად. CD133 ღეროვანი უჯრედებისა და პროგენიტორების ახალი მარკერია. CD133 ტრანსმემბრანული გლიკოპროტეინია 17, 18. ადრე მისი დასახელება იყო AC133, რაც შეცვლილ იქნა CD133-ზე, ადამიანის ლეიკოციტების ანტიგენებისადმი მიძღვნილ სიმპოზიუმზე დიდ ბრიტანეთში 2000წ-ს. CD133 ექსპრესირდება არამწიფე ღეროვან უჯრედზე და პროგენიტორებზე. CD34 ისაგან განსხვავებით ის არ აღინიშნება ბოლო რიგის პროგენიტორებზე (მაგ. პრე B უჯრედები, CFU-E, და CFU-G). CD133-ის აღმომჩენი ანტისხეულები ღებავენ CD34 უჯრედების 35-75%-ს მათ შორის ((CD34bright, CD38neg/dim, HLA-DR-, CD90 + და CD117 +) უჯრედებს (ანუ CD34 პოზიტიური უჯრედების 35-75% CD133-პოზიტიურია). ამასთან ერთად იდენტიფიცირებულია CD34-CD133+ უჯრედების გარკვეული რაოდენობა. 20, 21 ბოლო წლების კვლევებმა აჩვენა, რომ CD133 გვევლინება როგორც არაჰემოპოეზური სისტემის ღეროვანი უჯრედების და პროგენიტორების მარკერი. მაგ. ნერვული ღეროვანი უჯრედი, ემბრიონარული ღეროვანი უჯრედი და ზრდასრული ადამიანის ორგანიზმის პლურიპოტენტური ღეროვანი უჯრედები. ყველა ეს უჯრედი CD34 ნეგატიურია. 27, 28, 29. ნაჩვენები იქნა, რომ CD133+ CD34- უჯრედებს გააჩნიათ ვირთაგვის ექტოდერმალური მეზოდერმალური და ენდოდერმალური წარმოშობის ორგანოებში მიგრირების (მაგ. თავის ტვინის, განივზოლიანი კუნთის, გულის, ნაწლავის, ფილტვის, ღვიძლის) და დიფერენცირების უნარი 31. აგრეთვე ინ ვივო კვლევებში ნაჩვენები იქნა, რომ CD133 უჯრედებს გააჩნიათ ენდოთელიალურ უჯრედებად დიფერენცირების უნარი, ამდენად მათ გამოყენება ჰპოვეს ანგიოგენეზის სტიმულირებაში მიოკარდიუმის ინფარქტის შემდეგ 32,33,34. რიგ კვლევებში გამოვლინდა პერიფერიული სისხლის CD133 უჯრედების ნეირონებად დიფერენცირების უნარი. მათი ეს თვისება შემდეგში შესაძლოა გამოყენებულ იქნას თავის ტვინისა და ზურგის ტვინის ზოგიერთი დაავადების უჯრედული თერაპიისათვის 35. სიალისმჟავის გლიკოპროტეინები (გლიკოფორინი A, B, C, D, E) შეადგენენ ინტეგრალური პროტეინებად წოდებული გლიკოფორინების კლასს, რომლებიც წითელი უჯრედების მემბრანის პროტეინების დაახლოებით 2%-ს შეადგენენ. გლიკოფორინი A შედგება 131 ნაშთისაგან ის ატარებს სისხლის MN-ჯგუფის სპეციფიკას. კარბოჰიდრატის არსებობა გადასცემს უარყოფით იმპულსებს უჯრედის ზედაპირს. ეს ძალიან მნიშვნელოვანია იმისათვის, რომ შეამციროს ერითროციტების ურთიერთობა ერთმანეთთან და სხვა უჯრედებთან (მათ შორის სისხლძარღვების ენდოთელურ უჯრედებთან). GP-A შეაქვს წვლილი ზოგიერთი ვირუსისა და პარაზიტების ინვაზიასა და ზრდაში (მაგ: გრიპის ვირუსი, მალარია Plasmodium falciparum). 36, 37 მიაჩნიათ, რომ გლიკოფორინი A ქმნის კომპლექსს ერითროციტის მემბრანის სხვა კომპონენტებთან (ანკირინი, ბანდ-3, პროტეინი 4.2) და მათი ასოციაცია განაპირობებს წითელი უჯრედების მემბრანების მექანიკურ თვისებებს. 38, 39, 43-51 მასალები და მეთოდები: გამოკვლევაში მონაწილეობა მიიღო 49 პაციენტმა, რომლებიც იმყოფებოდნენ ჩვენი სტაციონარული და ამბულატორული მეთვალყურეობის ქვეშ 2002-2004 წლებში. მათ შორის 41 მამაკაცი და 8 ქალი, ასაკით 19 დან 59 წლამდე (საშუალო ასკი 40±4.7). პაციენტები დაყოფილ იქნა ორ ჯგუფად. I ჯგუფი შეადგინეს პაციენტებმა გულის ქრონიკული უკმარისობის სინდრომით. I-IV ფ.კ. (NYHA) (დილატაციური კარდიომიოპათია, გ.ი.დ მიოკარდიტი), რომელთა ექოსკოპიური და რენტგენოლოგიური გამოკვლევებით გამოვლინდა გულის საზღვრების გადიდება, განდევნის ფრაქცია 48%-დან 20%-მდე (საშუალოდ 35% ± 4,1%). II ჯგუფი (საკონტროლო ჯგუფი) შეადგინეს პაციენტებმა ვირუსული ჰეპატიტებით (B, C, ადენოვირუსი). II ჯგუფის პაციენტებს არ ჰქონდათ ჩივილები გულ-სისხლძარღვთა სისტემის მხრივ, ექოსკოპიური და რენტგენოლოგიური გამოკვლევებით არ აღენიშნებოდათ გულის საზღვრების გაზრდა, განდევნის ფრაქცია არ იყო 55%-ზე დაბალი. I ჯგუფი დაყოფილ იქნა ორ ქვეჯგუფად. Iა ქვეჯგუფი შეადგინეს პაციენტებმა გულის უკმარისობით I-II ფ.კ. (NYHA) და Iბ ქვეჯგუფი პაციენტებმა გულის უკმარისობით III-IV ფ.კ. (NYHA). Iბ ქვეჯგუფი მთლიანად შეადგინა დილატაციური კარდიომიოპათიით დაავადებულმა პაციენტებმა. ჩატარებული კვლევა ითვალისწინებდა პერიფერიულ სისხლში ღეროვანი უჯრედების, პროგენიტორებისა და ერითროიდული ხაზის ახალგაზრდა უჯრედების რაოდენობრივ შესწავლას. CD–მარკერების ექსპრესიის შესწავლა სისხლში ხდებოდა შემდეგი მეთოდიკით: გამოყენებული ხსნარების მომზადება: 1. ფოსფატური ბუფერი: PBS (Phosphate Buffered Saline, Sigma)-ის ერთი ტაბლეტი იხსნებოდა 200 მლ გამოხდილ წყალში. 2. 1%-იანი ალბუმინის ხსნარი (PBS/BSA) 500 მგ. ხარის შრატის ალბუმინი - BSA (Bovine Serum Albumin, Sigma) იხსნებოდა 50 მლ ფოსფატურ ბუფერში. 3. 1%-იანი პარაფორმალდეჰიდის ხსნარი (PFA) 5 გრ. პარაფოლმადეჰიდის ფხვნილი (Sigma) იხსნებოდა 500 მლ ფოსფატურ ბუფერში. სამუშაოს მსვლელობა: 100 მკლ სისხლის გადატანა ხდებოდა სინჯარებში, ემატებოდა 1–1 მლ 37°C-მდე შემთბარი ლიზის-ბუფერი (0,9% NaCl-FACS-Lysing Solution, გამზავებული 1:10, Becton&Dickinson) და ინკუბირდებოდა თერმოსტატში, 37°C – მდე ტემპერატურაზე 10 წთ. 1. ცენტრიფუგირების შემდეგ 1500 ბრ/წთ, 5 წთ ნალექი ირეცხებოდა ორჯერ 200 მკლ 1% PBS/BSA ხსნარით 1500 ბრ/წთ და ემატებოდა 10 მკლ ფლუორესცენტული ნივთიერებებით მონიშნული მონოკლონური ანტისხეულები: FITC~anti CD34 Human, (Biotech), PE~anti CD133 Human (Biotech), PE-anti GP-A Human (biotech) და იზოტიპური კონტროლისათვის FITC~mouse lgG (Pharmingen).
2. ინკუბირდებოდა 4°C, 40 წთ შემდეგ ირეცხებოდა ორჯერ PBS/BSA ხსნარით და ნალექის რესუსპენზირება ხდებოდა 1% პარაფორმალდეჰიდის ხსნარში. 3. ნიმუშები ანალიზდებოდა Becton&Dickinson -ის ანალიზატორის მეშვეობით. 4. მონაცემები სტატისტიკურად მუშავდებოდა კომპიუტერული პროგრამის შPშშ-ის საშუალებით. მონაცემები წარმოდგენილია საშუალო არითმეტიკულის მნიშვნელობებით და საშუალო არითმეტიკულის სტატისტიკური შეცდომის სახით. მაჩვენებლების განაწილების კანონი განსხვავდებოდა ნორმალური განაწილებისაგან და განსხვავება ჯგუფებს შორის ისაზღვრებოდა უიკოკსონ-მანნა-უიტნის U კრიტერიუმით. შედეგები: მიღებული შედეგები ქვემოთ წარმოდგენილია ცხრილებისა და გრაფიკების სახით (ცხრილი 1,2. დიაგრამა 1,2,3,4,5,6). ცხრილი #1.
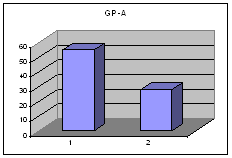
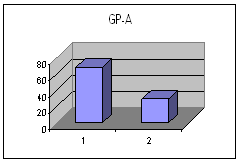
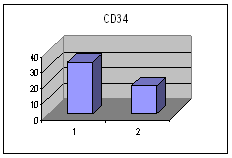
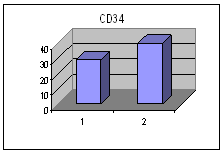
ღეროვანი უჯრედების, პროგენიტორებისა და ერითროიდული ხაზის ახალგაზრდა უჯრედების საშუალო პროცენტული რაოდენობა პერიფერიულ სისხლში I და II ჯგუფში ცხრილი #2. ღეროვანი უჯრედების, პროგენიტორების და ერითროიდული ხაზის ახალგაზრდა უჯრედების საშუალო პროცენტული რაოდენობა პერიფერიულ სისხლში Iა და Iბ ქვეჯგუფში
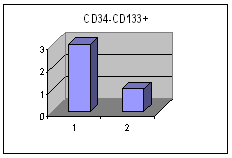
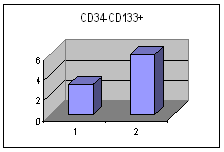
მონაცემთა სტატისტიკურმა დამუშავებამ გამოავლინა სტატისტიკურად სარწმუნო განსხვავება გულის უკმარისობით დაავადებულ პაციენტთა ქვეჯგუფებს შორის პერიფერიულ სისხლში GP-A დადებითი უჯრედების რაოდენობის მიხედვით (p<0.05). განსხვავება იყო ჯგუფებს შორის ღეროვანი უჯრედებისა და პროგენიტორების საშუალო პროცენტულ შემცვლელობებშიც I და II ჯგუფებს (27.38±8.11 და 15.86±6.42 შესაბამისად) შორის და Iა და Iბ ქვეჯგუფებს შორის (22.86±13.02 % და 34.13±14.16 % შესაბამისად), მაგრამ განსხვავება სტატისტიკურად სარწმუნო არ იყო - შესაძლოა ამონარჩევის სიმცირის გამო.
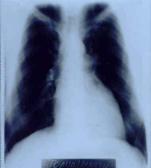
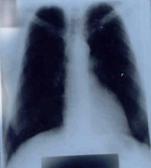
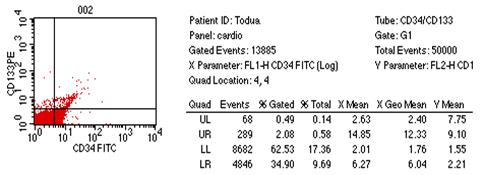
მოგვყავს ჩვენს მიერ აღნიშნულ მარკერებზე დინამიკაში (მკურნალობამდე და მკურნალობის შემდეგ) გამოკვლეული ერთ-ერთი ავადმყოფის ისტორია. ავადმყოფი თოდუა შ. 50 წლის. კლინიკაში შემოვიდა 29.XII. 2004 წელს. თავს ავად გრძნობდა 4 წლის განმავლობაში, როდესაც დაეწყო ქოშინი მცირე ფიზიკური დატვირთვისას, რასაც უკავშირებს ზემო სასუნთქი გზების ინფექციას. ამ ხნის მანძილზე მკურნალობდა სხვადასხვა კლინიკებში სტაციონარულად და ამბულატორულად დიაგნოზით: დილატაციური კარდიომიოპათია, გულის უკმარისობა III-IV ფ.კ. (NYHA), რაც მოიცავდა გლიკოზიდებითა და შარდმდენებით მკურნალობას. 4 წლის მანძილზე გულის ზომები რენტგენოლოგიურად და ექოსკოპიურად არ შეცვლილა (მარცხენა პარკუჭის საბოლოო დიასტოლური ზომა 7,8-8.1 სმ; მარჯვენა პარკუჭის საბოლოო დიასტოლური ზომა 4,3-4,5სმ; EF - 19-21%). ჩვენს კლინიკაში შემოსვლისას უჩიოდა ქოშინს მცირე ფიზიკური დატვირთვისას, უძილობას, ქვემო კიდურების პასტოზურობას.
პაციენტს ჩაუტარდა ვირუსოლოგიური კვლევები რამაც დაადასტურა დილატაციური კარდიომიოპათიის ვირუსული ეტიოლოგია (კოკსაკი B3, ადენოვირუსი), გამოვლინდა აგრეთვე ქლამიდიური და პნევმოცისტური პნევმონიის გამომწვევი აგენტების არსებობა. ავადმყოფს ჩაუტარდა ეტიოტროპული თერაპია და მანკიერი წრის პრევენცია სამიზნე ორგანოთა მაქსიმალური დაცვით, (სპეციფიური პროტექტორული და რეგენერაციული საშუალებების გამოყენებით), ნეიროჰუმორალური მედიკამენტოზური ბლოკადა, მაკრო და მიკრორეოლოგიური მაჩვენებლების კორექცია, მედიკამენტებითა და ინტრავენური ლაზეროთერაპიის საშუალებით (ζ-პოტენციალის გათვალისწინებით), მიკროელემენტების, ვიტამინებისა და ჰემოდინამიკური მაჩვენებლების კორექცია. პაციენტს შემოსვლისას და მკურნალობის შემდეგ ზემოთ აღნიშნულ და სხვა რუტინულ კვლევებთან ერთად ჩაუტარა პერიფერიული სისხლის გამოკვლევა მაჩვენებლებზე, რომლებიც მოყვანილია ცხრილში #3 და შესაბამის დიაგრამებში # 7,8. ცხრილი # 3.
ჩატარებული მკურნალობის შედეგად ავადმყოფის საერთო მდგომარეობა აღნიშნულ მონაცემებთან ერთად მნიშვნელოვნად გაუმჯობესდა. მოეხსნა ბივენტრიკულური უკმარისობა, შემცირდა გულის ზომები, გაიზარდა განდევნის ფრაქცია (მარცხენა პარკუჭის საბოლოო დიასტოლური ზომა 6,1სმ; მარჯვენა პარკუჭის საბოლოო დიასტოლური ზომა 3,1სმ; EF - 42%), სიცოცხლის ხარისხი საგრძნობლად გაუმჯობესდა.
დასკვნა: ბოლო წლების კვლევებში ნაჩვენები იყო, რომ სხვადასხვა ორგანოს დაზიანების შემთხვევაში შესაძლებელია გავაძლიეროთ რეგენერაციული პროცესები პერიფერიულ სისხლში ღეროვანი უჯრედებისა და პროგენიტორების რაოდენობის გაზრდის გზით. ამ მხრივ გულის უკმარისობის მკურნალობა განსაკუთრებით დიდ ინტერესს იძენს. ჯერ ერთი დადგენილია, რომ გულის კუნთს გარკვეული რეგენერაციის უნარი გააჩნია (Kajstura et al. 1998) 15. და მეორე ის რომ ჩვენს ადრინდელ კვლევებში დადასტურდა მანკიერი წრის ორგანოების მონაწილეობა გულის უკმარისობის სინდრომის პათოგენეზში 1, 2, 51, 52, და ღეროვანი უჯრედების მობილიზაციით შესაძლოა მივაღწიოთ მათში რეგენერაციული პროცესების სტიმულირებას. ჩვენს მიერ ჩატარებული კვლევის შედეგებმა გვიჩვენა, რომ გულის ქრონიკული უკმარისობის სინდრომისას ადგილი აქვს პერიფერიულ სისხლში ცოცხალი უჯრედების რაოდენობის შემცირებას საკონტროლო და ჯანმრთელ პირებთან შედარებით, რაც შეეხება ღეროვან უჯრედებსა და პროგენიტორებს CD34+, CD133+, CD34-CD133+) მათი რაოდენობა იზრდება გულის უკმარისობის პროგრესირების პარალელურად, ხოლო GP-A უჯრედების რაოდენობა კი შემცირებულია გულის უკმარისობის ზრდასთან ერთად და ზრდას იწყებს გულის უკმარისობის ხარისხის შემცირების პარალელურად, ეფექტური მკურნალობის ფონზე ასევე ადგილი აქვს ცოცხალი უჯრედების რაოდენობის მატებას გულის უკმარისობის შემცირების ფონზე. მივიჩნევთ, რომ გულის უკმარისობის სიმძიმის ზრდასთან ერთად ამ უჯრედთა რაოდენობრივი ცვლილებები ორგანიზმის სავარაუდო, სარეზერვო შესაძლებლობათა მდგომარეობაზე მიუთითებს. სამომავლოდ შესაძლებელი იქნება ამ პარამეტრების კლინიკურ პრაქტიკაში გამოყენება, დაავადების პროგნოზისა და მკურნალობის სტრატეგიის განსაზღვრისათვის, არსებული პოტენციური რეზერვის მიზანმიმართული მართვის გზით.
ლიტერატურა: 1. მ. როგავა 2001 “კარდიომიოპათიის მქონე ავადმყოფეში მანკიერი წრის კლინიკური ასპექტები” შრომათა კრებული II ტომი, “შინაგანი მედიცინეს მიღწევები და პრობლემები-2001” გვ. 6-9. 2. 2. მ. როგვა, ლ. ჭიღლაძე, თ. სანიკიძე, მ.ჩხაიძე, ე.გუჩუა, თ. ბოჭორიშვილი. “მანკიერი წრის სამიზნე ორგანოთა მორფო-უნქციური მდგომარება ვირთაგვებში ციტოკინდამოკიდებული ინდუცირებული ჰეპატიტის მოდელირებისას” ჟურნ. ”კარდიოლოგია და შინაგანი მედიცინა” #3 2003. გვ. 153-165.
3.
Tengis Tkebuchava, Atsuhiko Kawamoto, MD;, MD; Jun-Ichi Yamaguchi, MD;
Hiromi Nishimura, MD; Young-Sup Yoon, MD; Charles Milliken, BS; Shigeki
Uchida, MD; Osamu Masuo, MD; Hideki Iwaguro, MD; Hong Ma, BS; Allison
Hanley, BS; Marcy Silver, BS; Marianne Kearney, BS; Douglas W. Losordo,
MD; Jeffrey M. Isner, MD; Takayuki Asahara, MD “Intramyocardial
Transplantation of Autologous Endothelial Progenitor Cells for
Therapeutic Neovascularization of Myocardial Ischemia” (Circulation.2003;107:461.) 4. Полежаев Л.В. 1959 Новые методы замещения костных дефектов черепа. В кн. “труды 1-ого съезда хирургов росс. Федер. “Л. медгиз 276-280 5. Полежаев Л.В. 1963 Новое направление в учении о регенерации.-мед. газета 11 окт. №82 (2245) 6. Полежаев Л.В. Ахабадзе Л.В. Музлаева Н.А. Явич М.П. 1965 В кн. “Стимуляция регенерации мищцы сердца“ изд. “наука“. 7. მ. როგავა, ზ. ღურწკაია გულის უკმარისობის კორექციის მიდგომები და პერსპექტივები მოლეკულური ბიოლოგიის მიღწევათა სპექტრში ჟურნ. ”კარდიოლოგია და შინაგანი მედიცინა” #4 2003. გვ. 72-84. 8. Проблемы трансплантологии и искусственных органов. Юбилейный сборник научных трудов НИИ ТиИО. М. 1994. - 142 с. 9. Koh GY, Klug MG, Soonpaa MH et al. Differentiation and long - term survival of C2C12 myoblast grafts in heart. J Clin Invest 1993; 92 (3): 1548 - 54. 10. Li RK, Mickle DAG, Weisel RD et al. In Vivo Survival and Function of Transplanted Rat Cardiomyocytes. Circ Res 1996; 78 (2): 283 - 8. 11. Wang JS, Shum - Tim D, Galipeau J et al. Marrow stromal cells for cellular cardiomyoplasty: feasibility and potential clinical advantages. J Thorac Cardiovasc Surg 2000; 120:999 - 1006. 12. Jacques De Paepe 2003, “Dynamic support heart failure”. Jurn. “kardiologia da Sinagani medicina” #3 2003, gv. 115-129. 13. V.I. Kapelko 2002. “Myokardial Extracellular Matrix and Its Changes in Heart Diseases”. Kardiologia 9. 2000 14. Ю. Н. Беленков и соавт. 2003 “Мобилизация стволовых клеток костного мозга в лечении больных с сердечной недостаточностью”. 15. Kajstura J, Leri A, Finato N et al. Myocyte proliferation in endstage cardiac failure in humans. Proc Natl Acad Sci USA 1998; 95:8801 - 8805. 16. Бокеря Л. А., Бузиашвили Ю. И., Мацкеплишвили С. Т. Камардинов Д. Х., “Первый опыт применения стволовых клеток костного мозга для регенерационной терапии ишемической болезни сердца”. Журню Кардиология 9, 2004 ст. 16-22. 17. Miraglia et al. (1997) Blood 90: 5013-5021. [382] 18. Yin et al. (1997) Blood 90: 5002-5012. [383] 19. Behring et al. (2002); in Mason et al. (eds): Leucocyte Typing VII. Oxford University Press. 20. Gallacher et al. (2000) Blood 95: 2813-2830. [598] 21. Matsumoto el al. (2000) Stem Cells 18: 196-203. [1012] 22. de Wynter et al. (1998) Stem Cells 16: 387-396. [503] 23. Horn et al. (1999) Blood 93: 1435-1437. [685] 24. Behring et al. (1999) Blood 94: 832-833. [686] 25. Green et al. (2000) Leukemia 14: 770-772.[847] 26. Koehl et al. (2002) Bone Marrow Transpl. 29: 927-930. 27. Uchida et al. (2000) Proc. Natl. Acad. Sci.USA 97: 14720-14725. 28. Kaufman et al. (2001) Proc. Natl. Acad. Sci.USA 98: 10716-10721. 29. Verfaillie et al. (2002) Nature 418: 41-49. 30. Reyes et al. (2002) J. Clin. Invest. 109: 337-346. 31. Kuci et al. (2003) MACS&more 7/1. 32. Peichev et al. (2000) Blood 95: 925-958. [931] 33. Gehling et al. (2000) Blood 95: 3106-3112. [943] 34. Stamm et al. (2003) Lancet 361: 45-46. 35. Piechazek et al. (2003) MACS&more 7/1. 36. Chasis, J., and N. Mohandas. 1992. Red blood cell glycophorins. Blood 80: 1869-1879 37. Chishti, A Y., J. Palek, D. FiSher. 1996. Reduced invasion and growth of Plasmodium falciparum into elliptocytic red blood cells with a combined deficiency of protein 4.1, glycophorin C, and p55. Blood 87; 3462-3469 38. Bruce, L. J., Ghosh, M. J. King. 2002. Absence of CD47 in protein 4.2-deficient hereditary spherocytosis in man: an interaction between the Rh complex and the band 3 complex. Blood 100: 1878-1885. 39. Hassoun, H., T. Hanada. 1998. Complete deficiency of glycophorin A in red blood cells from mice with targeted inactivation of the band 3 (AE1) gene. blood 91:2146-2151. 40. “модeлировaниe пeптидов и Белков в мeмбрaнном окружeнии. II. структурныe и энeргeтичeскиe Аспeкты гликофоринa А в Бислоe” П. Е. Волынский, Д. Е. Нольде, А. С. Арсеньев, Р. Г. Ефремов. биологическая химия 2000 №3 с 163-172 41. მ. როგავა, ზ. ღურწკაია “გულის ქრონიკული უკმარისობის სინდრომით შეპყრობილ პაციენტთა პერიფერიული სისხლის იმუნოფენოტიპირების ზოგიერთი ასპექტები” ჟურნ. კარდიოლოგია და შინაგანი მედიცინა #4 2004 გვ. 47-51 42. ფ.თოდუა და თანაავტ. გულის იშემიური დაავადების დიაგნოსტიკა და მართვა მიოკარდიუმის ერთფოტონიანი ემისიური კომპიუტერული ტომოგრაფიის საფუძველზე. ჟურნ. კარდილოგია და შინაგანი მედიცინა 2004 @#1 91-95 43. Распространенность сердечно-сосудистых заболеваний возможности их профилактики Р Г Оганов) კარდილოგია და შინაგანი მედიცინა #1 2004 118-120 Steck TL: The organization of proteins in the human red ceel membrane. J Cell Biol 62:1, 1974 44. Marchesi VT: The stabilizing infrastructure of ceel membranes. Annu Rev Cell Biol 1:531, 1985 45. Bennett V: The spectrin – actin junction of erythrocyte membrane skeleton. Biochim Biophys Acta 988:107, 1989. 46. Bennett V, Lambett S: The spectrin skeleton: from red ceel to brain. J Clin lnvest 87:1483, 1991 47. Bennett V: ankyrins: adaptors between diverse plasma membrane proteins and the cytoplasm. J Biol Chem 267:8703, 1992. 48. davis LH, Bennett V: ldentification of two regions of beta G spectrin that bind to distinct sites in brain membranes. J Biol Chem 269:4409, 1994 49. Hochmuth RM, Waugh RE: Erythrocyte membrane elasticity and viscosity. Annu Rev Physiol 49:209, 1987 50. Loris zamia et al. TNF-related apoptosis-indusing ligand (TRAIL) as a negative regulator of normal human erythropoiesis. Blood. Vol. 95 No (June 15) 2000: pp. 3716-3724 51. М. А. Рогава Л. Л. Чигладзе М. Гудушаури Е. Е.Бочоришвили Г.К. Дидава. Спектр клинико-морфологических манифестаций порочного круга при кардиомиопатии и вирусных гепатитах. Georgian Journal of Radiology #2(11), 2002 46-50. 52. М. А. Рогава Порочный круг при кардиомиопатии и вирусных гепатитах Журн. алергология и имунология. Том 5 №3 стр. 382-385. 53. მ. როგავა, ე. გუჩუა, რ. გახოკიძე, თ. ბოჭორიშვილი. შე და ღბ-ის ნაერთების გავლენა კონტრაქტილურ ცილათა სისტემის კუმშვადობის უნარზე ციტოკინდამოკიდებული ინდუცირებული ჰეპატიტის მოდელირებისას განვითარებული მიოკარდიუმის დისფუნქციის დროს. კარდიოლოგია და შინაგანი მედიცინა XXI #4. 2003წ. გვ. 97-99 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||