|
Динамика
Перераспределения Иммунокомпетентных Клеток Курдгелия М., Лобжанидзе Т., Сихарулидзе Л. Государственная медицинская академия Грузии, кафедра внутренних болезней |
||||||||||||||||||||||||
|
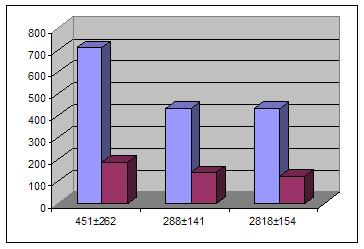
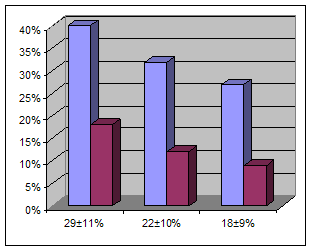
Болезнь Грейвса (БГ) – диффузный токсический зоб (ДТЗ), это системное аутоиммунное заболевание, развивающееся вследствие выpаботки антител к рецептору тиреотропного гормона (АТ-РТТГ), клинически проявляющееся поражением щитовидной железы (ЩЖ), с разитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией (эндокринная офтальмопатия, претибеальная микседема, акропатия) [1]. В регионах с нормальным потреблением йода, среди всех пациентов с тиреотоксикозом, 60 – 80% составляют больныее с ДТЗ. В целом ДТЗ относится к наиболее распространенным аутоиммунным заболеваниям. В йоддефицитных регионах в этиологической структуре токсического зоба ДТЗ конкурирует с функциональной автономией ЩЖ (узловой и многоузловой токсический зоб) [1,4]. ДТЗ является мультифакторным заболеванием, при котором генетические особенности иммунного реагирования реализуются на фоне действия окружающей среды [1,2,3]. Наряду с этнически ассоциированной генетической предрасположенностью, в патогенезе ДТЗ определенное значение имеют психосоциальные и средовые факторы. Эмоциональные, стрессорные и экзогенные факторы могут способствовать реализации генетической предрасположенности к ДТЗ. В результате нарушения иммунологической толерантности аутореактивные лимфоциты (СD4+, СD8+, Т- лимфоциты и В-лимфоциты) посредством адгезивных молекул инфильтрируют паренхиму ЩЖ, где распознают ряд антигенов, которые презентируются дендритными клетками, макрофагами, В-лимфоцитами, НLА-DR экспрессирующими фоликулярными клетками [1,2,5,6]. В дальнейшем цитокины и сигнальные молекулы инициируют антигенспецифическую стимуляцию В-лимфоцитов, в результате чего начинается продукция специфических иммуноглобулинов против различных компонентов тироцитов. В патогенезе ДТЗ основное значение имеет образование стимулирующих АТ-РТТГ. Эти антитела связываются с рецепторами тиреотропного гормона (ТТГ) и приводят его в активное состояние путем запуска каскадов цАМФ и фосфоионозиов, которые стимулируют захват щитовидной железой йода, синтез и высвобождение тиреоидных гормонов, а также пролиферацию тироцитов. В результате развивается тиреотоксикоз [1,2,4]. Показатели иммунного статуса при ДТЗ изучены достаточно широко [1,2,4], однако, эти исследования проводились, в основном, по показателям иммунитета периферической крови, что мало отражает состояние иммунитета в очаге поражения, динамику притока и оттока иммунокомпетентных клеток в артериальной, венозной и капиллярной крови органа-мишени. Вопросы перераспределения клеток иммунитета при ДТЗ являются мало изученными. В то же время, нередко, изменения в месте поражения, регионарная реакция лимфатической системы, является наиболее красноречивыми характеристиками болезни [4,5] и изучение этих вопросов в свете вышеизложенного актуально. Целью работы является изучение динамики перераспределения иммунокомпетентных клеток в системах регионарная артерия-регионарная вена щитовидной железы и локтевая вена-палец. Материалы и методы исследования. Объектом исследования являются лица грузинской национальности с ДТЗ, диагноз которым был поставлен на основании клинических и лабораторных исследований. Забор крови для определения перераспределения иммунокомпетентных клеток между системами артерия-региональная вена ЩЖ проводили 80 оперированным больным во время операции, которая была показана в случае неэффективности консервативной терапии. Во время операции, при пересечении мелких артерий и вен ЩЖ, устья этих сосудов канюлировались пластиковам шприцом, с последующим забором крови. Пересеченные сосуды в дальнейшем ушивались, таким образом, что получение проб крови не влияло на технику проведения операции. Одновременно с этим, для контроля, в системе локтевая вена–палец образцы крови были взяты у 128 неоперированных больных. Субпопуляционный состав лимфоцитов определяли всем больным в системе локтевая-вена палец и оперированным больным в системе регионарная артерия-вена ЩЖ; для выявления поверхностных маркров использовали моноклониальные антитела анти-СD3+, СD4+, СD8+, СD19+, СD25+, СD35+, СD16+56+. Полученные данные обрабатывали методом вариационной статистики. О достоверности различий судили по критерию Стьюдента p < 0,05. Результаты исследования и их обсуждение. При оценке артерио-венозного перераспределения иммунокомпетентных клеток между системами регионарная артерия-регионарная вена отмечено статистически достоверное падение уровня СD19+ при переходе из артерии в регионарную вену щитовидной железы. Относительное и абсолютное количество СD19+ клеток в артерии состовляло 451 ± 262 (29 ± 11%), что статистически достоверно выше, чем в регионарной вене щитовидной железы, где относительное и абсолютное количество СD19+ клеток состовляло соответственно 288 ± 146 (22 ± 10%). В качестве контроля были использованы показатели СD19+ клеток у тех же лиц в локтевой вене - 281 ± 154 (18 ± 9%), p < 0б05 (рис. 1)
рег. арт. рег. вена локт. вена рег. арт. рег. вена локт. вена Рис.1 Перераспределение СD19+ клеток при ДТЗ в грузинской популяции притекающих с артериальной кровью СD19+ клеток задерживается в щитовидной железе, или претерпевают там кое-какие изменения.
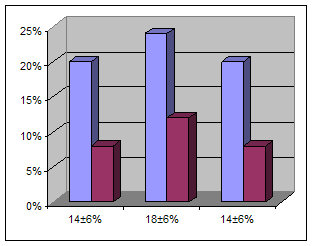
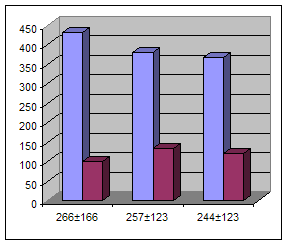
рег. арт. рег. вена локт. вена рег. арт. рег. вена локт. вена Рис. 2. Перераспределение СD25+ СD35+ лимфоцитов при ДТЗ в грузинской популяции Число СD25+ СD35+ клеток в щитовидной железе было значительно выше, чем в циркуляции, поэтому возможно увеличение оттока этих клеток из очага поражения. СD25+ СD35+ представляют собой активированные Т-лимфоциты, несущие на своей поверхности DR антиген, что может указывать на их существенную роль в переходе клеток иммунитета в интерстиций очага поражения. Субпопуляционный состав лимфоцитов периферической крови при ДТЗ, по сравнению с контрольной группой, показал достоверное (p < 0,05) снжение относительного количества цитотоксических (супрессорных лимфоцитов СD8+) и содержания NK (естетвенных киллеров) клеток (СD16+ СD56+). В качестве контроля были использованы показатели 150 здоровых донаров грузинской популяции. Относительное количество СD8+ клеток у больных составило 23 ± 1,8%, а в контрольной группе 30,1 ± 1.9%, различие было достоверным (р < 0,05). Относительное количество СD16+56+ клеток у больных составило 11 ± 1,4%, а в контрольной группе 17,84 ± 2.36%, различие было достоверным (р < 0,05) (табл. 1). Таблица 1 Содержание лимфоцитов в крови больных ДТЗ и контрольных лиц (%)
Средние показатели остальных субпопуляций лимфоцитов не отличались от таковых у лиц контрольной группы. Выявленные взаимосвязи между показателями иммунного статуса очага поражения и на периферии от него, оказались характерными для аутоиммунного процесса в щитовидной железе. Можно предположить, что выявленные взаимосвязи являются особенностью аутоиммунных заболеваний и характеризуют состояние иммунной ситемы при данной патологии. ЛИТЕРАТУРА. 1. Абрамова Н.А., Фадеев В.В. Консервативное лечение болезни Грейвса: принципы, маркеры рецидива и ремиссии .// Проблемы эндокринологии – 2005 - № 6 – с. 44 – 48. 2. Хаитов З.М., Игнатьева Г.А., Сидорович И.Г. Иммунология. М., «Медицина», 1999. 3. Ярилин А.А.Основы иммунологии. М., «Медицина», 1999. 4. Ярилин А.А.Гомеостатические процессы в иммунной системе. Контроль численности лимфоцитов. // Иммунология – 2005 - № 5 – с. 312 – 318 5. Laurence M., Demers Ph. Practical recommendations for thyroid gland function laboratory investigation// “Problemi endokrinologii” – 2004 - № 4 – p. 30 – 39 6. Roit G. et al. Immunology /Fifth ed./ Mosby, 1998. |
||||||||||||||||||||||||