|
ტროპონინ I-ს დინამიკა
ტოქსიკურ-ალერგიული
მ.
როგავა*, თ. ბოჭორიშვილი*, პ. ქანთარია*, ე გუჩუა*, გ. დიდავა** |
|||||||||||||||||||||||||||||||||||
|
დაავადების მოდელირება საცდელ ცხოველებზე წარმოადგენს მეტად მნიშ¬ვ¬ნე¬¬ლოვან სამეცნიერო და კლინიკური პრაქტიკის ძირითად ინტერესებს, რაც იძ¬ლე¬¬ვა საშუალებას ნათლად და ჯეროვნად იყოს წარმოდგენილი ამა, თუ, იმ და¬ავა¬¬დების პათოლოგიური პროცესების ეტაპობრივი განვითარების მიზეზები და გზები. ჩვენი კვლევის ინტერესს წარმოადგენს გულის კუნთის ყველაზე მძიმე და ვე¬რა¬გი დაავადების დილატაციური კარდიომიოპათიის (დკმ) შესაფერისი, ორიგინა¬ლუ¬რი მოდელის მიღება ექსპერიმენტში, რაც თავის თავში გულისხმობს გულის კუნთის დაზიანების შესაბამისი მოდელის შექმნას, რასაც მოყვება გულის ღრუე¬ბის გამოხატული დილატაცია და მიოკარდიუმის კონტრაქტილური ცილათა კუმ¬შვა¬¬დობის დაქვეითება, საბოლოოდ კი დილატაციური კარდიომიოპათიისთვის და¬მა¬ხა¬სიათებელი გულის უკმარისობის სინდრომის ჩამოყალიბება. არსებული მო¬დე¬ლი საშუალებას მოგვცემს განვიხილოთ ცნობილი ან შევქმნათ შესაბამისი ალ¬ტერ¬ნატიული მკურ¬ნალობის მეთოდები, რომლებიც უზრუნველყოფენ ადა¬მია¬ნის გამოჯან¬მრთელებას ან გააუმჯობესებენ არსებულ მდგომარეობას, დღევან¬დელ პირობებში მიღებული მკურნალობისა სტრატეგიის ფონზე. იმის გამო, რომ ძნე¬ლია ადექვატური მოდელის შექმნა მეცნიერები მიმართავენ სხვადასხვა ხერხს, ისინი ზოგჯერ სიმარტივისთვის [1] აიგივებენ მარცხენა პარკუჭის ანევ¬რიზ¬მის მოდელს, რომლის დროსაც ხდება ჰემოდინამიკური ცვლილებები: ქვეით¬დე¬ბა მარცხენა პარკუჭის განდევნის ფრაქცია, ხდება მარცხენა პარკუჭის რემო¬დე¬ლირება, მისი საბოლოო დიასტოლური მოცულობის (ზომის) გაზრდით, თუმცა დკმ-ისა¬გან განსხვავებით არის ე.წ. დემოგრაფიული ხაზი, სადაც ანევრიზმის ქსო¬ვი¬ლი და მის არეალში მყოფი სისხლის მოცულობა პრაქტიკულად არ მონა¬წი¬ლეობს კუმშვადობის პროცესში. აღნიშნული უბანი პირიქით ხელს უშლის არ¬სე¬ბუ¬ლი ჰემოდინამიკური პროცესის სწორად წარმართვას. გარდა ამისა კუმშ¬ვა¬დო¬ბის პროცესში უფრო აქტიურად მონაწილეობს გადარჩენილი, ჯანმრთელი (დაუ¬ზია¬ნებელი) მიოკარდი, რომელიც თავის თავზე იღებს და აძლიერებს კუმშ¬ვა¬დო¬ბის ამპლიდუდას. თუ დაზიანების ფართი დიდია (იგულისხმება მიოკარ¬დი¬უმი), მაშინ დარჩენილი ჯანსაღი მიოკარდიუმის სამჯერადი და მეტი აქტიუ¬რო¬ბაც არ იძლევა დამაკმაყოფილებელ შედეგს და საერთო მარცხენა პარკუჭის გან¬დევნის ფრაქცია მაინც დაბალი რჩება. ხოლო, რაც შეეხება ჯანმრთელი მიო¬კარ¬¬დიუმის არეალში არსებულ განდევნის ფრაქციას იგი ნორმაში არსებულ ციფ¬რებს საკმაოდ აჭარბებს [2]. ჩვენი საზრით ეს მოდელი დილატაციური კარ¬დიო¬მიოპათიის კვლევის და მით უმეტეს მკურნალობის პროცესში მიუღებელია, რად¬განაც დკმ-ის დროს მიოკარდიუმის კუმშვადობა ყველა სეგმენტში (ტოტა¬ლუ¬რად) თითქმის ერთნაირად არის დაქვეითებული. კიდევ ერთი მოდელი, რომელიც მრა¬ვალი ავტორის მიერ იყო [3,4,5,6] გამოყენებული დკმ-ის მოდელირე¬ბი¬სათ¬ვის, არის, ელექტროსტიმულაცია მარჯვენა პარკუჭიდან ჩანერგილი ელექტრო¬სტი¬მულატორით 180-190 დარტყმა/წუთში, რომელიც 21 დღის შემდეგ იცვლებოდა 200-210-ით დარტყმა/წუთში, ოცდამეერთე დღეს საშუალოდ 10%-ით მცირდებოდა გან¬დევნის ფრაქცია [7,8,10,11] სელექტიური კათეტერიზაციით კორონარულ არტე¬რია¬ში 90 მიკრონის სიდიდის პოლიმეთილენლოქსანის ჰიდროგენის შეყვანის შე¬დე¬გად კი ცხოველთა ლეტალობა 30%-ს შეადგენდა, რის დროსაც მიღწეული იყო გულის ღრუების გადიდება, ხოლო მარცხენა პარკუჭის განდევნის ფრაქცია მცირ¬დებოდა 30-40%-მდე [7,8,9]. აღნიშნული მოდელი ბევრ ტექნიკურ სირ¬თუ¬ლეს¬თან არის დაკავშირებული, მაგალითად როგორიცაა სელექტიური კათეტე¬რიზა¬ცია და მაღალი სიკვდილობა, რაც მეტად ძვირად ღირებულია მასიური ცდების ჩა¬სა¬ტარებლად და ეტიო-პატოგენეზურადაც მკვეთრად განსხვავდება კლინიკური რეა¬ლობისაგან და ჩვენი საზრით არ აკმაყოფილებს რეალურად არსებულ მო¬დე¬ლი¬რების მოთხოვნებს. ცნობილია, ყოველდღიურ კლინიკურ პრაქტიკაში და ასე¬ვე სამეცნიერო წრეებში მკვიდრდება აზრი იმის შესახებ [10], რომ დკმ-ის ერთ-ერთ ძირითად და წამყვან მიზეზად სახელდება სხვადასხვა გენეზის (ვირუსული, ტოქსი¬ური, აუტოიმუნური) ანთებითი პროცესი. კურდღლებში დიდი ხანია ოქროს ეტალონად მიღებულია ტოქსიკურ-ალერ¬გი¬ული მიოკარდიტის (ტამ) ს.ვ. ანდრეევის 1973 წლის მეთოდი, რომლის ექსპერი¬მენ¬ტულ მოდელზე უთვალავი შრომებია ჩატარებული უცხოელი და ჩვენი ავტო¬რების მიერ [11]. ჩვენ გადავწყვიტეთ ბაზისურ მოდელად მიგვეღო არსებული და მისი შესაბამისი მოდიფიკაციით მიგვეღო დილატაციური კარდიო¬მიოპათიის სუ¬რა¬¬თი, რაც გამოგვივიდა კიდევაც. ექსპერიმენტი ტარდებოდა სუფთა ხაზის მამრ კურდღლებზე, რომლებიც ექს¬¬პერიმენტის დაწყებამდე 15 დღის განმავლობაში იმყოფებოდნენ კარანტინის პი¬რო¬¬ბებში. ცხოველთა შენახვის ზოგადი პირობები თანაბარი იყო. ექსპე¬რი¬მენ¬ტის დროს ცხოველებს საკვებთან და წყალთან მისვლა თავისუფლად შეეძლოთ. ცდის დაწყებამდე ყველა ექსპერიმენტული ცხოველი იწონებოდა და ხდებოდა ტემ¬პერატურის განსაზღვრა. კვლევაში ჩატარებული იქნა 2000-2200 გრამ წონის 26 მამრ კურდღელზე. საექსპერიმენტო ცხოველები დაყოფილი იყო ორ: I სა¬კონტ¬როლო – 6 კურდღელი და II აქტიური ჩარევის - 20 კურდღელი ჯგუფად. ამ უკა¬ნას¬კნელში ტოქსიკურ-ალერგიული მიოკარდიტი გამოიწვეოდა Андреев С.В.1973 მეთოდიკით [12]. კურდღლები სენსიბილიზდებოდა 2 მლ. ცხენის შრატის ვე¬¬ნაში 4 დღის შუალედით შეყვანით. 7 დღის შემდეგ ვენაში შეგვყავდა სტაფი¬ლო¬¬კოკური ტოქსინი 0,1 მლ/კგ. II ჯგუფი შემთხვევითი შერჩევის მეთოდით დაი¬ყო IIა და IIბ ქვეჯგუფად. IIა ქვეჯგუფი იკვეთებოდა 10 დღის შემდეგ, IIბ ქვე¬¬ჯგუ¬ფის კურდღლებში შეგვყავდა დამატებით მე-XI დღეზე, ჯანმრთელი ხარის ლი¬ოფილიზირებული შრატი (Normal Bovine Lyophilized Serum - Biolabd Exatpol-n (France)) 0,1 მლ/კგ წონაზე +კოფეინი 0,1 მლ/კგ წონაზე, ცხოველთა გაკვეთა ხდე¬ბო¬¬და მე-17-ე დღეს, ბიოეთიკის აღიარებული პრინციპების დაცვით. ტროპონინი I ს შესწავლა პერიფერიულ სისხლში იმუნო¬ფერმენტული მეთოდით ხდებოდა ექსპერიმენტის დაწყებამდე ორივე ჯგუფში, IIა ჯგუფში მე-10 და IIბ ჯგუფში I ელ, მე-10, მე-12 და მე-17 დღეს. აქტიური ჩარევის ჯგუფში ტარდებოდა ელექ¬ტრო¬კარ¬¬დიოგრაფიული კვლევა I-ელ, მე-10, მე-12 და მე-17 დღეს. ელექტროკარდიოგრამის გადაღება ხდებოდა Малыш- ის ტიპის ერთარხიან ელ. კარდიოგრაფზე. ისწავლებოდა გულის კუნთის შეკუმშვისა და მოდუნების პროცესი შემდეგი მე¬¬თო¬დიკით: მიოკარდიუმის სკინირებული ბოჭკოების (მსბ) მიღება ხდებოდა გ. სუ¬¬კოიანის და თანაავტ. მიხედვით [13], რომელიც დაფუძნებულია Magid & Reedy (1980)-ის მეთოდეზე. Aამ მიზნით მარცხენა და მარჯვენა პარკუჭის ტრაბეკუ¬ლები¬დან, აგრეთვე, მარცხენა და მარჯვენა წინაგულებიდან აღებული სინჯები (20X2X2მმ³) ფიქსერდებოდა ხის ჩხირზე დაჭიმულ მდგომარეობაში და თავს¬დე¬ბოდა 1 არეში (0,1 M NaCl, 3 mM KCl, 2mM MgCl2 ImM DTT, 5mM EGTA, 0,5 mM FMSF, 10mM NaN3, 15mM იმიდაზოლი pH 7,4, pCa>8, μ- 0,139). შემდეგ ტრაბეკულები გადაიტანებოდა არეში, სადაც ხდებოდა სკინირება (არე 1 + 0,5 ტრიტონ X-100) და თავსდებოდა ერთი საათის განმავლობაში მაგნიტურ სარევზე დაბალ სიჩქა¬რე¬ზე. ტრიტონ X-100-ს მოცილება ხდებოდა 6-12 საათის განმავლობაში 1 არის მრა¬ვალჯერადი გამოცვლით. ცდის წინ სკინირებული ბოჭკოები გადაიტანებოდა არეში 2, რომელიც შეიცავდა: 0,1 M NaCl, 3 mM KCl, 2mM MgCl2 ImM DTT, 5mM EGTA, 0,5 mM FMSF, 10mM NaN3, 15mM იმიდაზოლი pH 7,4, pCa>8, μ- 0,125). ასეთ არეში ხდებოდა სკინირებული სინჯების პრეპარირება სტანდარტული მსბ-ის, სიგრძით 4,7±0,2 და განივი ჭრილის ფართობი 0,024±0,002 მმ³. ამ გზით მიღებულ მსბ-ს ელექტრონული მიკროსკოპიის მონაცემების მიხედვით, შენარჩუნებული აქვთ სარკომერის ულტრასტრუქტურული ორჯანიზაცია [გ. სუკოიანი და თანაავტ.] [14].³ გულის მორფოლოგიური ცვლილებების შესასწავლად მასალას ვაფიქსი¬რებ¬დით 10% ნეიტრალურ ფორმალინში, კარნუას სითხეში ფიქსირებულ ნაწილებს მზარ¬დი კონცენტრაციის სპირტით გაუწყლოვნების შემდეგ ვათავსებდით პარა¬ფი¬ნულ ბლოკებში. მომზადებული სერიული ანათლები იღებებოდა ჰემატოქსილი-ეოზი¬ნით. მონაცემები სტატისტიკურად მუშავდებოდა კომპიუტერული პროგრამის SPSS- ის საშუალებით. მაჩვენებლების განაწილების კანონი განსხვავდებოდა ნორმალური განაწილებისაგან და განსხვავება ჯგუფებს შორის ისაზღვრებოდა მანნა-უიტნის U კრიტერიუმით (არაპარამეტრული მეთოდი). ექსპერიმენტული ცხოველების ჯგუფებში აქტიურ ჩარევამდე და აქტიური ჩარევის შემდეგ განსხვავებას ვადგენდით უილკოკსონის t კრიტერიუმით დამოკიდებული ცვლადებისათვის. განს¬ხვავება ჯგუფებს შორის სტატისტიკურად სარწმუნოდ ითვლებოდა თუ P<0.05.
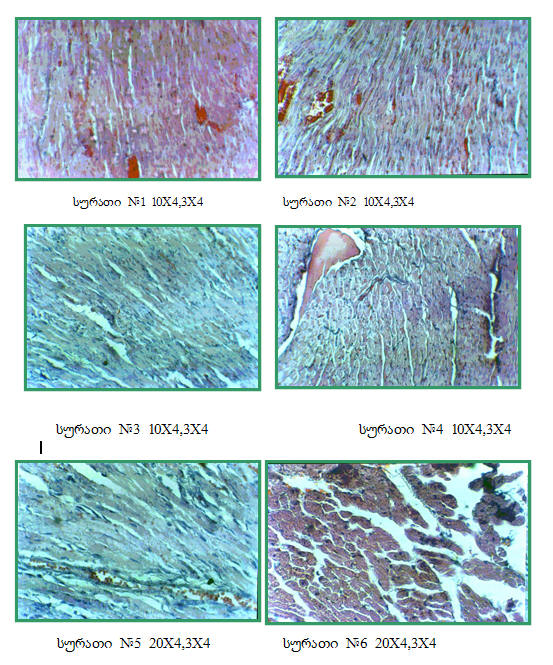
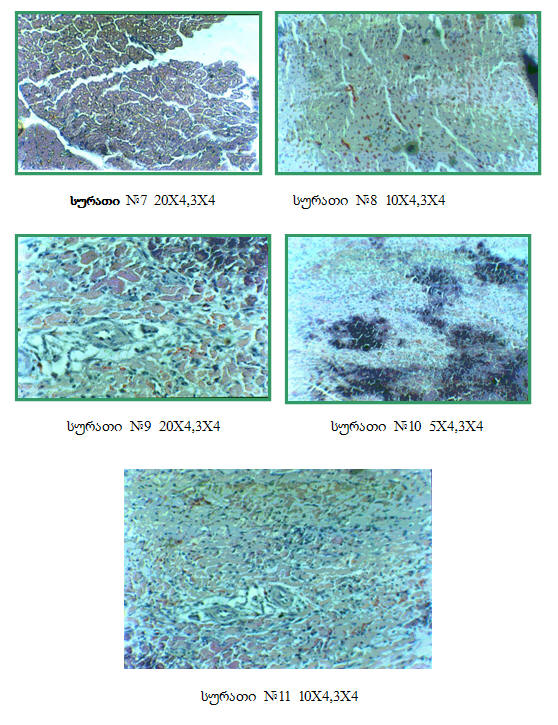
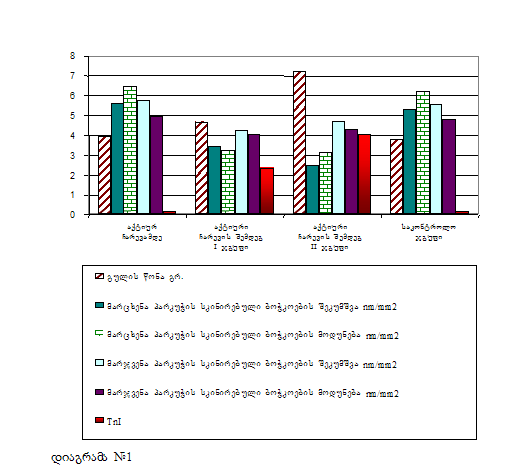
ჩატარებული ექსპერიმენტიდან მიღებული შედეგების მიხედვით აღმოჩნდა, რომ 10-დღიანი ტოქსიკურ-ალერგიული მიოკარდიტის შემთხვევაში ტროპონინ I-ს მნიშვნელობა საკონტროლო ჯგუფთან შედარებით 40-ჯერ, ხოლო დილატაციური კარდიომიოპათიის შემთხვევაში კი 70-ჯერ აღემატებოდა ნორმას. შესაბამისად შემცირდა მარცხენა პარკუჭის კუმშვადობა 27%-ით ტოქსიკურ-ალერგიული მიოკარდიტის, ხოლო დილატაციური კარდიომიოპათიის დროს კი 42%-ით. ჩვენ ვთვლით, რომ არსებული ექსპერიმენტული მოდელი წარმოადგენს მარტივ ორიგინალურ მეთოდს დილატაციური კარდიომიოპათიის შესწავლის პროცესში, რადგანაც იგი მიღებულია ტოქსიკურ-ალერგიული მიოკარდიტის აუტოიმუნური დაზიანების შედეგად, რასაც მოhყვა გულის ღრუების მკვეთრი რემოდელირება ჯანმრთელ და ტოქსიკურ-ალერგიულ მიოკარდიტთან შედარებით, აგრეთვე კუმშვადობის მკვეთრი დაქვეითება, რაც ჩატარებულმა კვლევებმა დაადასტურა კიდევაც (ცხრილი #1 და დიაგრამა #1), მკვეთრად დაქვეითდა აგრეთვე კუმშვადობისა და რელაქსაციის პროცესი ნორმასთან და ტოქსიკურ-ალერგიულ მიოკარდიტთან შედარებით. ასევე შესაბამისად შეცვლილი იყო მიოკარდიუმის მორფოლოგიური სურათი ტოქსიკურ-ალერგიული მიოკარდიტის (სურ 1,2,3,4) და დილატაციური კარდიომიოპათიის (სურ. 5-10), ნორმასთან შედარებით (სურ 11). ჩვენ ვთვლით, რომ დკმ-ის აღნიშნული მოდელი შედარებით მარტივი და ადვილად მისაღწევია, ექსპერიმენტის პროცესში ლეტალური გამოსავალი კი 2%-ს არ აღემატება. ძალიან ახლოს დგას, როგორც ეტიოპათოგენეზურ, ისე კლინიკურ მიმდინარეობასთან. ლიტერატურა:
1.
И.Н.
Стакан, О.И. Козлов, С.А Курганович соовт – Экспериментальная аневризма
левого желудочка как модель забодевания сердца с сердечной
недастаточностью- 2004 г. 2. М.А. Рогава - Эхокардиографическая диагностика постинфарктных аневризм левго желудочка сердца -1985г. (автореферат). 3. M. Byrne, J. Raman, J. Power et al. – passive ventricular constraint : an effective intervention for the treatment and advanced dilated cardiomyopathy// European Heart Journal. – 2000. -21 (suppl). – P. 293. 4. E. Monnet, C.C. Chachques. – Animal models of heart failure: what is new?// Annals of Thoracic Surgery. – 2005 – 79, P. 1445-53. 5. J.M Power, J. Raman, A. Dornom et al. Passive ventricular constraint amends the course of heart failure: a study in an ovine model of dilated cardiomyopathy// Cardiovascular Reseasch. – 1999. – 44, P. 549-555. 6. J. Raman, J. Power, B. Buxton et al. Passive ventricular containment in the treatment of experimental dilated cardiomyopathy// Journal of American College of Cardiology – 1999. – 33, P. 208A. 7. C.А Шалимов, А.П. Радзиховский, Л.В Кейсевич – Рукавоство по экспериментальной хирургии – Медицина, 1989, с. 272. 8. Б. В Петровский, И. З Козлов – Аневризьы сердца – Медицина, 1965. с.277. 9. H. N. Sabbah, P. A. Chaudhry, G. Paone et al. Passive ventricular constraint with the Acorn prosthetic jacket prevents progressive left ventricular dilation and improvens ejection fraction in dogs with moderate heart failure // Journal of American College of Cardiology – 1999, 33, P. 207A. 10. Iversen P. Rogava M. Kipshidze N, Tsapenko M Kipshidze NN. Successful Treatment of the Viral Myocarditis by Antisense Phosphorodiamidate Morpholino Oligomer (pmo) Bazed Vaccine in an Experimental Model .International Journal of Cardiovascular Medicine and Science. Vol. 6, # 2, p 65-150, 2003. 11. 11. როგავა მ. ყიფშიძე ნ. გაბელაია ნ. მიოკარდიუმის უკმარისობის ზოგიერთი საკითხი ტოქ¬სიკურ-ალერგიული მიოკარდიტის დროს. კარდიოლოგია და შინაგანი მედიცინა XXI 2002. # 2, გვ.102-106. Андреев С.В. Tоксико-аллергическим миокардит.// Бюлл экспер биол. - 1973.- №4.- С.395-399. 12. Н.В.Карсанов, Г.В. Сукоян, И.К.Джибгашвили и др. Субклеточная патофизиология недостаточности сердца, обусловленной токсико-аллергическим миокардитом и действие рефрактерина на внутрисердечную гемодинамику и функциональное состояние трех субклеточных систем, ответственных за акт сокращение-расслабление // Пат. физиол.- 1999.- № 3.- С.3-8. 13. Г.В. Cукоян, Д.Р.Татулашвили, Н.В.Карсанов Конформационные изменения в актине миокарда при сердечной недостаточности, обусловленной токсико-аллергическим миокардитом.// Бюлл экспер биол. - 1999.- №4.- С.395-399. |
|||||||||||||||||||||||||||||||||||